Chapitre OS5 – Oscillateurs harmoniques et amortis (exercices uniquement)
Contenu :
- Oscillateur harmonique : établissement de l’équation différentielle, résolution avec des conditions initiales données.
- Signal sinusoïdal : notion d’amplitude, de phase, de période, de fréquence et de pulsation.
- Oscillateur amorti : établissement de l’équation différentielle, discussion sur les régimes possibles en fonction de la valeur du facteur de qualité, résolution avec des conditions initiales données, ordre de grandeur du régime transitoire.
- Bilan énergétique.
- Analogie entre oscillateurs mécanique et électronique.
Chapitre CTM4 – Réactions acido-basiques et de précipitation (cours et exercices)
Questions de cours :
- Réaction acide/base : équation d’échange protonique, constante d’acidité, pKA et exemples, notion de base forte et d’acide fort (avec exemple).
- Tracé d’un diagramme de prédominance et de distribution pour un couple acide/base.
- Prévision de réaction pour deux couples acide-base (autres que les couples de l’eau) : règle du gamma, lien avec les domaines de prédominance, expression de la constante d’équilibre associée.
- Détermination de la constante d’équilibre pour une réaction faisant intervenir un couple de l’eau, au choix du khôlleur.
- Réaction de dissolution ou précipitation, définition du produit de solubilité KS et application à la recherche d’un domaine d’existence du précipité sur un exemple au choix du khôlleur.
- Solubilité : définition, facteurs influençant la solubilité (au moins trois), exemple de calcul sur un exemple au choix du khôlleur.
- Effet d’ion commun : explication générale et exemple du chlorure d’argent AgCl (pKs = 9,8) avec les deux situations rencontrées dans le cours (pour le khôlleur : ajout d’un ion Ag+ ou Cl– à une solution initialement saturée mais sans solide et cas d’une dissolution avec présence initiale d’un des deux ions).
Contenu :
- Constante d’acidité, diagrammes de prédominance et de distribution.
- Identifier le caractère acido-basique d’une réaction en solution aqueuse.
- Écrire l’équation de la réaction modélisant une transformation en solution aqueuse en tenant compte des caractéristiques du milieu réactionnel (nature des espèces chimiques en présence, pH…) et des observations expérimentales.
- Déterminer la valeur de la constante d’équilibre pour une équation de réaction, combinaison linéaire d’équations dont les constantes thermodynamiques sont connues.
- Déterminer la composition chimique du système dans l’état final, en distinguant les cas d’équilibre chimique et de transformation totale, pour une transformation modélisée par une réaction chimique unique.
- Constante de l’équation de dissolution, produit de solubilité, solubilité et condition de précipitation, domaine d’existence, facteurs influençant la solubilité.
- Prévoir l’état de saturation ou de non saturation d’une solution.
- Utiliser les diagrammes de prédominance ou d’existence pour prévoir les espèces incompatibles ou la nature des espèces majoritaires.
- Exploiter des courbes d’évolution de la solubilité d’un solide en fonction d’une variable.
Chapitre M3 – Approche énergétique en mécanique du point (cours uniquement)
Questions de cours :
- Puissance et travail d’une force. Exemple d’une force constante et d’une force de frottements.
- Démonstration du théorème de l’énergie cinétique et application à la détermination de la vitesse obtenue après une chute libre d’un objet, sans vitesse initiale, d’une hauteur
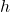 .
. - Force conservative, énergie potentielle, et exemple de calcul au choix du khôlleur (gravitationnelle, rappel élastique, pesanteur à la surface terrestre).
- Démonstration du théorème de l’énergie mécanique et détermination de l’équation différentielle du pendule simple.
- Analyse du mouvement à l’aide d’un graphe d’énergie potentielle.
- Position d’équilibre, stabilité, et approximation locale par un puits de potentiel harmonique.



